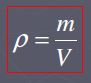SUHU
DAN KALOR
(Part
1)
Suhu
Bagaimana jika kita
mengukur temperatur air es? Kita mengukur panas yang dimiliki air tersebut
(baik dalam keadaan panas maupun dingin)
Temperatur adalah ukuran
panas yang dimiliki oleh suatu benda. Panas yang dimaksud biasanya dikenal
dengan istilah kalor.
Suhu merupakan ukuran
atau derajat panas atau dinginnya suatu benda atau sistem. Suhu didefinisikan
sebagai suatu besaran fisika yang dimiliki bersama antara dua benda atau lebih
yang berada dalam kesetimbangan termal. Untuk mengukur dan mengkuantitatifkan
pengukuran suhu digunakan alat pengukur suhu yang dinamakan termometer. Alat
ini bekerja berdasarkan sifat termometrik zat. Nilai suhu suatu benda
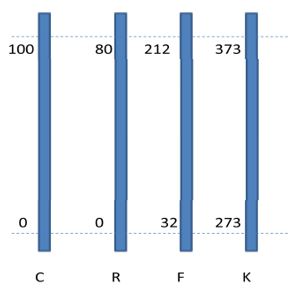
dinyatakan dalam beberapa skala suhu, dan skala suhu yang umum digunakan adalah
skala Celcius (C), Reamur (R), Fahrenheit (F), dan Kelvin (K).
Berikut perbedaannya.
Berikut contoh
perhitungan hubungan skala Celciusdan skala Fahrenheit
Prinsip diatas juga
berlaku untuk jenis skala yang lainnya.
Pengaruh panas dan dingin
(perubahan nilai suhu) pada suatu benda menyebabkan perubahan wujud dan sifat
benda. Perubahan wujud dapat terjadi manakala suhu benda mencapai titik leleh
atau titik didihnya. Setiap benda juga dapat mengalami pemuaian ketika
dipanaskan, dan menyusut ketika didinginkan, akan tetapi pengecualian pada air,
dimana air memiliki sifat anomali air pada rentang suhu 0 °C hingga 4 °C. Pada
zat padat dapat terjadi pemuaian panjang, pemuaian luas, dan pemuaian volume,
sedangkan pada zat cair dan gas hanya dapat terjadi pemuaian volume saja.
Pemuaian Panjang
Sebuah benda atau zat padat yang
berbentuk batang tipis (seperti kawat logam yang berdiameter kecil) ketika dipanaskan
akan mengalami perubahan panjang ke arah panjangnya, sehingga benda-benda
seperti ini dikatakan mengalami pemuaian panjang. Oleh karena bentuknya yang
dominan ke arah panjangnya, sehingga aspek pemuaian luas dan volumenya relatif
sangat kecil dibandingkan pemuaian panjangnya, sehingga pemuaian luas dan
volumenya dapat diabaikan.
Pemuaian Luas
Bila zat padat yang dipanaskan
tidak berbentuk batang tipis, melainkan berbentuk pelat atau
kepingan, maka pemuaian tidak hanya
terjadi ke arah panjangnya saja, tetapi juga ke arah lebarnya. Atau dengan kata
lain, zat padat tersebut mengalami pemuaian luas.
Pemuaian Panjang Volume
Idealnya, suatu zat padat tidak
hanya akan mengalami pemuaian panjang atau pemuaian luas, tetapi mengalami
pemuaian volume atau pemuaian ruang. Hal ini dikarenakan pada dasarnya
bagaimanapun bentuk suatu benda padat atau zat padat, selalu memiliki dimensi
ruang (panjang, lebar, dan tinggi) sehingga pemuaian zat padat ketika zat padat
itu dipanaskan adalah memuai ke segala arah atau mengalami pemuaian volume.
Tulisan ini diambil dan diolah
dari sumber :
http://file.upi.edu/Direktori/FPMIPA/JUR._PEND._FISIKA/198108122005011-AGUS_FANY_CHANDRA_W/Suhu_dan_Kalor_[Compatibility_Mode].pdf
http://file.upi.edu/Direktori/DUAL-MODES/KONSEP_DASAR_FISIKA/BBM_6_%28Suhu_dan_Kalor%29_KD_Fisika.pdf